[Literatur]
[ vorherige Seite
| Index | nächste
Seite ]
Die Haemolymphe der Individuen beider Arten tritt an einer Wunde erst durch leichtes Drücken auf das betäubte Tier aus. Der Blutdruck ist also sehr gering. Erwachen die Tiere nach der Entnahme von Haemolymphe aus der Narkose, ist der Haemolymphedruck von der Aktivität der Rumpfmuskulatur abhängig. Wenn sich die Tiere bewegen, kann weitere Haemolymphe aus der Wunde austreten.
Von Scolopendra cingulata, mit Lebendgewichten von 2,5 bis 4,5 g, konnten pro Blutung zwischen 100 und 250 µl Haemolymphe entnommen werden, von den viel leichteren Lithobius forficatus, mit etwa 0,1 g Lebendgewicht, nur zwischen 2 und maximal 20 µl.
Die Haemolympheentnahme wird von den Tieren gut überstanden und hatte nur in wenigen Fällen letale Folgen für die Tiere. Der Wundverschluß dauert etwa einen Tag, am zweiten Tag nach dem 'Bluten' ist die Wunde leicht melanisiert. Die Extremitäten regenerierten bei späteren Häutungen. Von Tieren beider Arten kann mehrfach Haemolymphe entnommen werden.
Die Haemolymphe von S. cingulata ist schwach gelblich, die von L. forficatus farblos. Sie ist bei beiden Tiere wegen der Haemocyten schwach opak. Bei S. cingulata lag die Gesamthaemocytenzahl pro Mikroliter Haemolymphe bei 31.400 (± 9700; n=2 ) und bei L. forficatus bei 45.200 (± 21.800; n=4).
Die Osmolalität der Haemolymphe betrug bei S. cingulata 372 mosmol kg-1 (n=1), bei L. forficatus 320±40 mosmol kg-1 (n=4).
Bei S. cingulata reagiert die Haemolymphe mit pH 8 leicht basisch, bei L. forficatus ist sie mit pH 6,5-7 neutral bis schwach sauer.
In der frisch entnommen Haemolymphe sind die Haemocyten zunächst flach-discoid bis kugelig (Abb. 74). In den Spreitungspräparaten mit Kulturmedium verändern sie ihre Gestalt: Einige Haemocyten spreiten mehr oder weniger stark auf dem Objekträger und bilden Filopodien und Lamellopodien, andere bilden große lamellopodienartige Zellfortsätze, die eher in den Raum hineinragen als sich auf einem Substrat zu spreiten.
Aufgrund ihres Verhaltens in der kurzfristigen Zellkultur, ihrer histochemischen
und besonders ihrer ultrastrukturellen Eigenschaften ließen sich vier
Haemocytentypen bei S. cingulata unterscheiden und in die Kategorien
"Prohaemocyte", "Discoide Haemocyte", "Granulocyte" und "Adipohaemocyte"
einordnen (s. auch ).
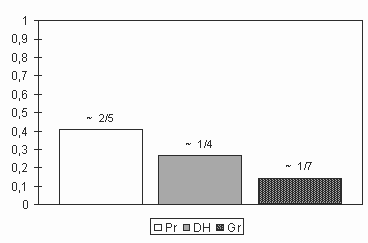
Die Prohaemocyten sind kleine, kugelige bis fusiforme Zellen (s.Abb. 8, 9,74 und 75) mit einem Durchmesser von etwa 5 µm (sie können aber bis zu 10 µm lang sein). Im Phasenkontrast sind die meist nichtgespreiteten Prohaemocyten stark lichtbrechend. Im elektronenmikroskopischen Bild erscheint der zentral liegende Kern abgerundet mit wenigen flachen Ausbuchtungen. Der Kern ist mit 2/5 des Zellvolumens vergleichsweise groß (Abb. 6). Prohaemocyten haben kein äquatoriales Mikrotubulibündel (s.u.). Sie enthalten einzelne kleine Grana, einige kleine Vesikel, ein mäßig umfangreiches, rauhes, endoplasmatisches Retikulum, viele freie Ribosomen und einige Mitochondrien (Abb. 8 und 9).
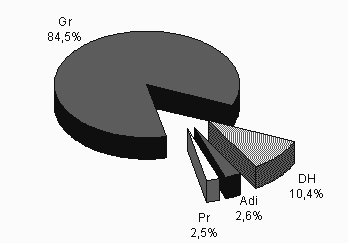
Auf Semidünnschnitten von unverdünnten Haemolymphepräparaten haben sie eine relative Häufigkeit von 3,7 %, im Anschnittflächenverhältnis sind sie aber nur zu 2,5 % vertreten (Abb. 7).
Diese Haemocyten sind im nativen Zustand flachdiscoid. Im Phasenkontrastbild erscheinen die liegenden Zellen wenig lichtbrechend grau (Abb. 48), bei seitlicher Ansicht sind sie allerdings stark brechend hell. Sie haben einen Durchmesser von ca. 9 µm bei einer Höhe von nur etwa 3 µm.
Das auffälligste Merkmal der Ultrastruktur Discoider Haemocyten ist ein dickes äquatoriales Mikrotubulibündel mit z.T. über 60 Mikrotubuli im Anschnitt. Es scheint die discoide Form dieser Zellen zu stabilisieren (Abb. 10). Die Zellkerne liegen nur wenig exzentrisch in den Zellen und nehmen etwas mehr als 1/4 des Zellvolumens ein (Abb. 6). Das Cytoplasma enthält viele kleine (ø » 0,15 bis 0,35 µm), und wenige große (ø » 1 µm), elektronendichte Grana (s. Tafel 2). Weiterhin treten kleine elektronenhelle Vesikel auf, die in einigen dieser Haemocyten sehr zahlreich sind. Andere Zellen dieses Typs haben große Vakuolen (ø 1,5 µm) oder Lakunensysteme ausgebildet (Abb. 14 u. 15). Der Inhalt der Vakuolen entspricht im TEM-Bild dem Haemolympheplasma, ist aber etwas elektronendichter.
Einige Discoide Haemocyten sind in vitro sehr empfindlich; direkt nach der Haemolympheentnahme sind sie schon vakuolisiert (Abb. 14). Andere zeigen noch nach 30 min in vitro ohne Kulturmedium (Abb. 16) oder sogar nach 3 h in Graces-Medium ihre native, flachdiscoide Gestalt (Abb. 11).
Im REM-Bild spreitender Discoider Haemocyten aus der kurzfristigen Zellkultur sind in der Zellmembran Öffnungen erkennbar, die mit der inneren Vakuolisierung im Zusammenhang zu stehen scheinen (Abb. 11 u.12). Discoide Haemocyten können dünne filopodienartige Zellausläufer bilden (Abb. 17 u. 18) und trennen membranumschlossene Cytoplasmafragmente ab (Abb. 18, 20, 21 und 95).
In Knötchen sind Discoide Haemocyten und ihre Fragmente vornehmlich im Zentrum anzutreffen. Diese Anordnung war besonders gut in Präparaten ohne Medium nach 30 min zu beobachten (Abb. 20, 21 u.76). Das von den Discoiden Haemocyten bei ihrem Zerfall abgegebene Material scheint andere Haemocyten, vornehmlich Granulocyten, anzulocken (s. a. Kap. 3.7) und zu der Koagulation der Haemolymphe beizutragen.
Die relative Häufigkeit der Discoiden Haemocyten beträgt 12,5 %; auf Semidünnschnitten war ihr Anschnittflächenverhältnis etwa 10 % (Abb. 7).
Granulocyten haben in der frisch entnommenen Haemolymphe einen Durchmesser von 7-11 µm und zunächst eine kugelige bis discoidale Gestalt (Abb. 13 u. 74). Auf Semidünnschnitten sofort fixierter Haemocyten ist oft ein 'Ektoplasmasaum' von etwa 1 µm Breite zu erkennen (Abb. 74). Nach 10 min in vitro (ohne Medium) erscheinen die Zellkörper der Granulocyten abgerundet und etwas kleiner (ø 8-9 µm). Sie haben dann einen lamellopodienartigen Cytoplasmaschweif gebildet (Abb. 75), so daß sie häufig eine Gesamtlänge von mehr als 15 µm, in Einzelfällen bis 20 µm erreichen. Auch in der sofort fixierten Haemolymphe können einzelne Granulocyten mit Cytoplasmaschweif auftreten (Abb. 13).
In den Spreitungspräparaten sind Granulocyten im Phasenkontrast- und Interferenzkontrastbild stark lichtbrechend und haben oft einen schwach gelblichen Farbstich (Abb. 61 u. 62). Granulocyten haften an Glasobjektträgern (Abb. 57 u. 58), spreiten aber nur wenig. Bei Präparationen auf Cellophanfolie spreiten sie mit einzelnen Ausnahmen ebenfalls kaum (Abb. 19 u. 23). Bei der Knötchenbildung und z.T. auch in den Spreitungspräparaten wurden einzelne Granulocyten beobachtet, die sehr flach auf dem Substrat gespreitet waren (Abb. 23). Ihre Gestalt gleicht der von Plasmatocyten.
Das Zentralplasma der Granulocyten ist mit sehr vielen elektronendichten Grana prall gefüllt (Abb. 20-22,24). Auf einem Querschnitt können mehr als 50 große (ø 0,6-1,5 µm) und weitere kleine (ø 0,3 µm) Grana erkennbar sein. Die kleinen Grana sind immer elektronendicht, die großen lassen sich anhand ihrer inneren Struktur in vier Typen unterteilen (Abb. 25-27): Typ 1 ist homogen elektronendicht, Typ 2 fein strukturiert elektronendicht, Typ 3 grob strukturiert und unterschiedlich elektronendicht, Typ 4 elektronendicht und 'schaumig'.
Die grob strukturierten Grana (Typ 3) können mehr oder weniger viel elektonendichtes Material enthalten, und es kommt vor, daß sie mit den elektronendichten Grana (Typ 1) verschmelzen (Abb. 25).
Außer Grana sind in Granulocyten zwei Vakuolentypen zu beobachten, die sich anhand ihres Inhalts unterscheiden lassen. Beide können zum umgebenden Kulturmedium hin geöffnet sein und ihren Inhalt exocytieren (Abb. 29). Der eine Vakuolentyp enthält faseriges Material, welches dem aufgelockerten Inhalt der grob strukturierten Grana (Typ 3) entspricht (Abb. 26 u. 28). Der Ursprung des nichtfaserig strukturierten 'grauen' Inhalts des zweiten Vakuolentyps ist weniger deutlich. Er entwickelt sich anscheinend aus angeschwollenen Zisternen des rauhen ER, wie sie in einigen Granulocyten (und Discoiden Haemocyten) zu sehen sind (Abb. 25,89,96, 97 u. 99). Sonst erscheint das ER nicht sehr umfangreich, und auch freie Ribosomen sind nicht sehr zahlreich vorhanden.
Der Golgi-Komplex der Granulocyten wird begleitet von einem Schwarm elektronendichter Vesikel und kleiner Grana, die in seiner Nähe häufig fusionieren (Abb. 28).
Die Kerne liegen exzentrisch (Abb. 22, 24 u. 28) und sind polymorph: einmal erscheinen sie kompakt oval, in anderen Zellen sind sie gelappt; oft sind die Kerne auch durch Grana, Vakuolen oder Phagosomen tief eingebuchtet. Das Heterochromatin scheint etwas weniger umfangreich als bei Prohaemocyten und Discoiden Haemocyten zu sein. Ein Nucleolus ist nicht immer angeschnitten, aber regelmäßig vorhanden. Der Kern nimmt nur etwa 1/7 des Zellvolumens ein und ist damit deutlich kleiner als bei Prohaemocyten und Discoiden Haemocyten (s. Abb. 6 und ).
Ähnlich wie bei den Discoiden Haemocyten wird auch bei den Granulocyten im nativen Zustand die Zellform durch ein äquatoriales Mikrotubulibündel stabilisiert. Es ist hier aber deutlich weniger umfangreich und stabil. In vitro wurde dieses Cytoskelettelement wohl auch im Zusammenhang mit der Ausbildung der Lamellopodien bald umgewandelt (in Spreitungspräparaten mit K-Ringer ist es z.T. noch nach 30 min erhalten). Fragmente der Mikrotubulibündel sind in Granulocyten von Knötchen noch auszumachen: sie treten dort nicht mehr in ihrer nativen Lage, sondern an eher 'willkürlichen' Stellen im Cytoplasma auf.
Bündel eines weiteren Cytoskelettelements, womöglich von Aktinfilamenten, sind an der Bildung der Lamellopodien beteiligt. Im EM-Bild sind sie in Form hellerer Streifen (besonders nach Inkubation mit Dopa, s. Kap. 3.4.1) zu erkennen, die regelmäßig axial in den Fortsätzen verlaufen (Abb. 22). Das Lamellopodium wird bevorzugt in eine Richtungen ausgestreckt - es legt sich nur selten dem Substrat an, sondern ist meist frei in das Kulturmedium hinein gerichtet. Es enthält außer den Cytoskelettelmenten etwas ER und freie Ribosomen, aber keine großen, membrangebundenen Organellen.
Granulocyten sind phagocytoseaktiv und maßgeblich an der Bildung von Knötchen beteiligt; dort können sie an der Außenseite epithelartig angeordnet sein, ohne sich jedoch zu spreiten (s. Kap. 3.7).
Die Granulocyten von S. cingulata haben eine relative Häufigkeit von 82 % und auf Semidünnschnitten (sofort fixierter Haemolymphe ohne Medium) ein Anschnittflächenverhältnis von über 84 % (s. Abb. 7). In den Spreitungspräparaten kann ihr Anteil deutlich darunter liegen, da die Zellen beim Spülen der Präparate z.T. fortgewaschen werden.
Ein weiterer Zelltyp tritt selten auf und wird hier als 'Adipohaemocyte' bezeichnet. Die Zellen sind unregelmäßig geformt, können ungespreitet mehr als 25 µm × 10 µm messen und sind prall mit bis >2 µm großen, membranumschlossenen Grana gefüllt (Abb. 60). Die Grana enthalten mäßig elektronendichtes Material, in das noch dunklere Strukturen eingelagert sein können, der Inhalt der Grana ähnelt allerdings nicht Lipidtropfen. Die Form des Zellkerns wird von den benachbarten Grana bestimmt. Der Kern nimmt nur einen kleinen Teil des Zellvolumens ein. Die Zellen sind weder PO- noch Px-aktiv, können sich aber z.T. auf dem Substrat spreiten (Abb. 50/51 u. 58). Die Funktion dieses Zelltyps ist nicht bekannt.
Die Ultrastruktur der Haemocyten von L. forficatus, einige ihrer färberischen Eigenschaften und wenige Aspekte ihrer Immunreaktionen wurden bereits von NEVERMANN (1989) und von NEVERMANN et al. (1991) beschrieben. Daher wird hier nur eine Übersicht gegeben. Die älteren sowie die neuen und ergänzenden Befunde sind mit denen für S. cingulata in zusammengefaßt.
Bei L. forficatus sind vier (fünf?) Haemocytentypen differenziert:
(1) "Prohaemocyten" sind kleine, kugelige, granaarme Haemocyten, die sich oft nicht spreiten. Ungespreitet messen sie weniger als 9 µm im Durchmesser.
Neu sind Beobachtungen, von sehr flach gespreiteten Prohaemocyten, die Durchmesser von bis zu 20 µm erreichen können (Abb. 43) und z.T. phagocytoseaktiv sind (Abb. 113).
(2) "Plasmatocyten" spreiten sich schnell und gut auf Glasobjektträgern (Abb. 43-47) und messen etwa 10-30 µm. Sie enthalten einige Grana, die denen der Granulocyten (s.u.) sehr ähnlich sind, und sie bilden Vakuolen, aus denen strukturiertes Material exocytiert wird.
Die Präparate ohne Kulturmedium haben gezeigt, daß Plasmatocyten teilungsaktiv sein können. In dem Präparat der Abb. 33 waren etwa 0,5 % der Haemocyten in Teilung begriffen.
(3) Die granareicheren "Granulocyten" spreiten sich schlechter als Plasmatocyten, bleiben also länger ovoid. Wenn Granulocyten sich spreiten, tun sie das in ganz ähnlicher Weise wie die von S. cingulata. Sie bilden nämlich auch einen Cytoplasmaschweif aus. Wie die Plasmatocyten können auch Granulocyten strukturiertes Material exocytieren (s. Kap. 3.5.1).
In den mit Dopa inkubierten EM-Präparaten wurden im Cytoplasmaschweif dieser Zellen nun ebenfalls elektronenhelle Spuren nichttubulärer Cytoskelettelemente beobachtet (Abb. 31), wie sie für die Granulocyten von S. cingulata beschrieben worden sind (s. Kap. 3.2.3). In Präparationen ohne Medium wurden auch einzelne Granulocyten mit einem äquatorialen Mikrotubuli-Bündel beobachtet (Abb. 32), der in Spreitungspräparaten sowie in den früheren Arbeiten nicht beobachtet worden ist.
(4) "Sphaerulocyten" sind oft größer als die anderen Haemocytentypen. Ihr Cytoplasma ist mit vielen ausgesprochen kugeligen Grana angefüllt. Sie spreiten sich deutlich schlechter als Granulocyten oder Plasmatocyten.
In den neuen Versuchen zur Knötchenbildung und Phagocytose wurden einzelne Fälle von phagocytoseaktiven Sphaerulocyten beobachtet. Meist sind diese Zellen in den Präparaten jedoch passiv.
(5) "Coagulocyten" sind sehr instabil, sie können durch Exocytose (oder 'Zerfallen') die Koagulation des Haemolympheplasmas auslösen. Sie wurden von NEVERMANN et al. (1991) nur in mit Formaldehyddampf fixierten Ausstrichen beobachtet. Es erscheint fraglich ob sie tatsächlich einen eigenständigen Zelltyp darstellen.
In den neuen Präparaten ohne Medium sind nämlich Zellen beobachtet worden, die den Plasmatocyten sehr ähnlich sind und in vitro sofort stark vakuolisieren (Abb. 30). Womöglich sind Coagulocyten stark 'gereizte' Plasmatocyten.