
Teil IV
[Literatur]
[vorherige Seite |
Index
| nächste Seite ]
In fixierten Haemocyten von L. forficatus und S. cingulata läßt sich PO-Aktivität durch Inkubation mit Dopa-Lösung enzymhistochemisch nachweisen.
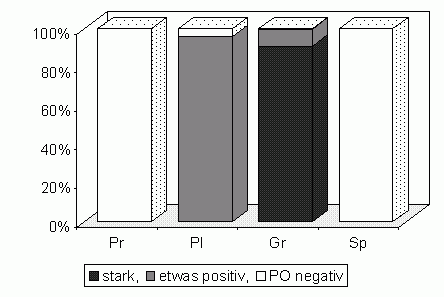
Bei L. forficatus führt die PO-Aktivität nach 1-8 h Inkubation mit Dopa-Lösung zu einer Melanisierung innerhalb der PO-positiven Haemocyten; lichtmikroskopisch sind gerade noch Strukturen in den stärker positiven Zellen erkennbar. Nach 16 bis 20 h Inkubation sind die Haemocytentypen deutlich unterschiedlich stark geschwärzt (Abb. 34). Insgesamt sind dann fast 90 % aller Haemocyten mehr oder weniger stark melanisiert. Die Färbung tritt vornehmlich im Cytoplasma auf, doch sind in Plasmatocyten und in schwächer gefärbten Granulocyten gelegentlich einzelne stärker positive Grana zu erkennen (Abb. 45). Die immer PO-positiven Granulocyten sind außer in ihren z.T. sehr flachen Lamellopodien undurchsichtig schwarz; nur wenige Granulocyten zeigen geringere Färbung. Die Plasmatocyten sind manchmal nicht, meist jedoch etwas bis mittelstark gefärbt (Abb. 44-47). Prohaemocyten (Abb. 43) und Sphaerulocyten (Abb. 45-47) sind immer PO-negativ.
Auch im EM-Bild ist das Cytosol der PO-positiven Haemocyten nach 6 h Inkubation mit Dopa-Lösung elektronendichter als das der PO-negativen Zellen (Abb. 110). Daß aber auch Grana PO-aktiv sind, läßt sich nur erkennen, wenn die Schnitte nicht kontrastiert werden: In den PO-negativen Haemocyten sind alle Grana so wenig elektronendicht wie das Cytoplasma. In den PO-positiven Zellen sind dagegen einige Grana deutlich elektronendichter als andere und die cytoplasmatische Umgebung (Abb. 112).
 |
 |
| Abb. 34: Verteilung der PO-Aktivität in Haemocyten von L. forficatus (n=576). | Abb. 35: Verteilung der PO-Aktivität in Haemocyten von S. cingulata (n=478). |
Bei S. cingulata ist die PO-Aktivität erheblich schwächer: Erst nach ca. 20 h ist das Ergebnis ähnlich intensiv wie bei den Haemocyten von L. forficatus schon nach 8 h. Insgesamt werden etwa 35 % der Haemocyten überhaupt melanisiert, und die Färbung ist hier nicht deutlich zelltypspezifisch: Die Mehrheit der Granulocyten zeigt PO-Aktivität, aber etwa 25 % sind negativ oder nur wenig positiv. Von den Discoiden Haemocyten waren etwa 8 % und von den Prohaemocyten 2 % etwas PO-positiv (Abb. 35). Die seltenen und in den Zählungen nicht erfaßten 'Adipohaemocyten' waren, soweit angetroffen, immer PO-negativ (Abb. 50/51).
Lichtmikroskopisch ist bei S. cingulata (wie zuvor bei L. forficatus) die PO-Aktivität besonders im Cytosol zu erkennen (s. Tafel 7). Der typische Cytoplasmaschweif der Scolopendra-Granulocyten ist stärker melanisiert als das zentrale Cytoplasma mit seinen in Kernnähe zusammengedrängten Grana, die hier deutlich PO-negativ erscheinen (Abb. 52 u. 53).
In den EM-Präparaten der S. cingulata-Haemocyten war die Wirkung der PO nach 8 h Inkubation noch zu schwach, um eine ähnlich deutliche Schwärzung wie bei L. forficatus zu erhalten. Dennoch führte sie zu einer 'Kontrastierung' im Cytoplasma einiger Granulocyten. So wurden in diesen Präparaten im Cytoplasmaschweif die Stellen heller abgebildet, an denen gebündelte, Cytoskelettelemente liegen (Abb. 21 u. 22).
Bei L. forficatus und S. cingulata läßt sich die PO-Aktivität in den Spreitungspräparaten vollständig durch PTU blockieren: Auch nach 20 h Inkubation mit Substrat und PTU bleiben alle Zellen ungefärbt. Die Ethanol-Inkubation der Spreitungspräparate hatte bei beiden Chilopodenarten keinen erkennbaren Effekt auf die PO-Aktivität.
Zur Bestimmung des 'Molekulargewichts' der PO wurden die Haemolympheproteine in der PAGE aufgetrennt, danach in den Gelen renaturiert und mit Dopa-Lösung inkubiert. Am Ort der PO-Aktivität erscheint zunächst eine orangefarbene Dopachrom-Bande, die sich mit der Zeit zu braun-schwarzem Melanin umsetzt (Abb. 36).
Das Molekulargewicht (MW) dieser PO-Banden wurde aus den nach MW-Standards erstellten Eichgeraden abgeschätzt. Für die PO-Bande von Lithobius ergibt sich daraus ein MW von knapp 200 kDa bzw.190 kDa (Abb. 36-38).
In der Scolopendra-Haemolymphe war die PO-Aktivität nach der Elektrophorese erheblich schlechter und z.T. auch gar nicht nachweisbar. Es traten hier zwei Banden auf, die Molekulargewichten von 150 kDa und 90 kDa entsprechen (Abb. 36 u. 37).
PTU und Tropolon (auch mit H2O2) führten auf den Gelen zu einer totalen Blockade der PO-Aktivitäten beider Chilopoden-Arten. Aminotriazol ließ bei Lithobius noch eine verminderte Umsetzung von Dopa zu, bei S. cingulata war das Ergebnis nicht eindeutig.
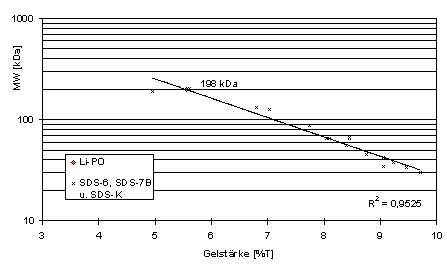 |
Abb. 38: MW der PO-aktiven Bande von
L. forficatus. Eichgerade nach mit SDS-K, SDS-6 und SDS-7B. 3-10 % PAGE von Haemolymphe in Probenpuffer mit EDTA u. PMFS.
|
Die Oxidation von DAB mit H2O2 durch Px-Aktivität liefert ein braunes Reaktionsprodukt in den Px-positiven Haemocyten von L. forficatus und S. cingulata.
Die Verteilung der Px-Aktivität auf die Haemocytentypen von L. forficatus ist ganz ähnlich wie die der PO-Aktivität. Prohaemocyten und Sphaerulocyten sind Px-negativ, Plasmatocyten können schwach Px-positiv sein und Granulocyten sind meist stärker Px-positiv (Abb. 54-56). Innerhalb der Zellen erscheint die Px-Aktivität deutlich auf einzelne Grana konzentriert, das Cytoplasma ist oft nicht gefärbt.
Auch bei Scolopendra ist die Verteilung der Px-Aktivität auf die Haemocytentypen ähnlich wie die der PO. In den Prohaemocyten und den Discoiden Haemocyten sowie in den 'Adipohaemocyten' wurde keine Px-Aktivität beobachtet. Granulocyten sind Px-positiv, die Aktivität tritt besonders in Grana im zentralen Cytoplasma auf. Im Cytoplasmaschweif und in den Filopodien ist keine Px-Aktivität erkennbar (Abb. 57 u. 58).
In den Spreitungspräparaten ließ sich die Px-Aktivität in Lithobius- und Scolopendra-Haemocyten durch PTU und Aminotriazol inhibieren.
Nach der Elektrophorese, Renaturierung und Inkubation mit DAB und H2O2 erscheinen die Px-aktiven Banden an den gleichen Positionen im Gel, wie die der PO-Aktivität (Abb. 36). Eine inhibierende Wirkung von Aminotriazol war bei S. cingulata nicht vollständig und bei L. forficatus nicht erkennbar.
Wurden die Gele für 48 h in DAB ohne H2O2 inkubiert, waren schwache Banden an den Stellen im Gel erkennbar, an denen die PO- bzw. Px-Aktivität zu erwarten ist.
Weder bei L. forficatus noch bei S. cingulata konnten Phosphatase- oder unspezifische Esteraseaktivität in den Haemocyten histochemisch beobachtet werden. Die Färbungen für den Nachweis unspezifischer Esterase ergaben zwar eine differenzierte Färbung besonders der Granulocyten-Grana beider Chilopoden-Arten (Abb. 59, 60), jedoch unterschied sich diese Färbung nicht von der in den Kontrollen ohne Naphtol AS Acetat.
Die Lysozymaktivität der Haemolymphe von L. forficatus ließ sich durch Lysishoftests nachweisen. Dabei ergab sich für einen Lithobius-Haemolymphe-Pool von drei unbehandelten Tieren eine Lysozymaktivität, die knapp1 µg (etwa 22 U) des Standardlysozyms pro ml Haemolymphe entsprach. Die lytische Aktivität wurde durch Mischen der Haemolymphe mit Anti-Lysozym-AK nicht beeinträchtigt. Die Werte für Haemolymphe plus 1:250 und 1:500 verdünnten Anti-Lysozym-AK erscheinen zwar gerinfügig niedriger, der Wert für Haemolymphe plus 1:2 verdünnten Anti-Lysozym-AK entspricht aber dem Wert für Haemolymphe ohne AK (Abb. 39).
Nach der Trennung von Haemocyten und Plasma durch Zentrifugation (s. 2.9.1) konnte in der lMl-PAGE gezeigt werden, daß Lysozymaktivität nur in den Haemocyten vorhanden ist (Abb. 41). In den Laufspuren der Plasmaproben konnte keine Lysozymaktivität beobachtet werden (außer Kontamination in Spur 5 aus Spur 4).
Nach seiner relativen Mobilität in der lMl-PAGE hat das Lithobius-Lysozym ein Molekulargewicht von 15,2 kDa (Abb. 40).
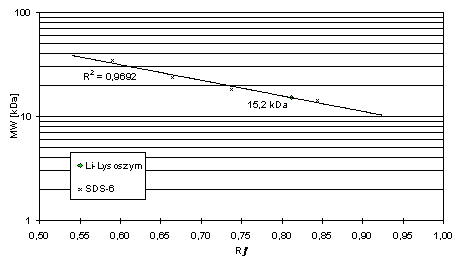 |
Abb. 40: Bestimmung des MW von L.
forficatus-Lysozym. Eichgerade nach relativer Mobilität (Rƒ) des MW-Std. SDS-6 (ohne 45 u. 66 kDa) auf 15 % lMl-PAGE.
|
Die immuncytochemische Färbung hat für beide Chilopoden signifikant positive und negative Haemocyten ergeben. Zellaggregate waren bei beiden Chilopoden besonders stark gefärbt (Abb. 61 u. 64). Außer Haemocyten wurde bei beiden Tieren auch extrazelluläres Material markiert (Abb. 62 u. 64). Die Kontrollen waren jeweils eindeutig negativ.
Bei S. cingulata zeigten insgesamt weniger Haemocyten lysozymartige Immunreaktivität als bei L. forficatus. (Abb. 61). S. cingulata-Granulocyten wurden oft nur extrazellulär gefärbt, aber die meisten Discoiden Haemocyten sind deutlich positiv (Abb. 62).
Bei L. forficatus waren die allermeisten Zellen positiv. Die Färbung scheint hier stärker auf Grana konzentriert zu sein als bei S. cingulata, und Granulocyten wurden stärker als Plasmatocyten markiert (Abb. 63); dagegen waren Sphaerulocyten gar nicht gefärbt (Abb. 64).
Um zu zeigen, daß der Anti-Lysozym-AK spezifisch reagiert und daß tatsächlich auch L. forficatus-Lysozym durch den AK markiert werden kann, wurde an die Trennung der Haemolympheproteine in der lMl-PAGE ein Western Blot angeschlossen. Das aktive Lysozym des MW-Standards SDS-6 und das nicht aktive, vorgefärbte Lysozym des MW-Standards SDS-K wurden auf der Nitrozellulose deutlich markiert. In den Laufspuren der Haemolymphe konnte aber an der Position der Lysozymaktivität keine Markierung durch den Anti-Lysozym-AK gefunden werden. Allerdings wurden in den Laufspuren der Haemolymphe in Bereichen, die erheblich höheren Molekulargewichten entsprechen, verschiedene Banden gefärbt, die im Lysistest keine Aktivität haben (Abb. 42).
[Literatur]
[ vorherige Seite
| Index
| nächste Seite ]
Copyright © 1996
Dr. L. Nevermann
[ Letzte Aktualisierung 21.07.00 LN ]